Las células madre extraídas mediante lipoaspiración de la grasa generalmente abdominal son una parte importante de la medicina regenerativa. El sistema que utilizamos en ITRAMED es el sistema Lipogems®. Un sistema cerrado de manipulación de células madre mesenquimales y con un procesado mecánico del tejido graso.
¿Y por qué elegimos las células madre del tejido graso?
La atención se centra cada vez más en las células madre derivadas del tejido adiposo humano y animal debido a su abundancia y facilidad de acceso en zonas como la abdominal, flancos o en cara lateral de los muslos.
Ha pasado más de un siglo desde que se describieron por primera vez las células madre como células “ancestrales” de las que se originan el resto de las células [1], y desde entonces, se han publicado un gran número de estudios y descubrimientos sobre su potencial y aplicación en medicina regenerativa y cirugía. En concreto, se pueden encontrar más de 40.000 artículos en Medline mediante la búsqueda de células madre mesenquimales adultas (Mesenchymal Stem Cells – MSCs) derivadas de médula ósea, pulpa dental, membrana fetal y placenta a término, entre otros múltiples tejidos. Estudios experimentales han demostrado que las células madre mesenquimales humanas pueden diferenciarse in vitro en varios linajes celulares, tales como osteoblastos, condrocitos, miocitos y adipocitos [2].
En los últimos 15 años, se ha demostrado que las células madre mesenquimales adultas (MSCs) también pueden promover la vasculogénesis (formación de vasos sanguíneos), el principal mecanismo implicado en la eficacia de la reparación de los tejidos [3-4].
La atención se centra cada vez más en las MSCs derivadas del tejido adiposo humano y animal debido a su abundancia y facilidad de acceso. Estas células multipotentes pueden diferenciarse en adipocitos maduros, así como condrocitos, osteoblastos, miocitos, y otros linajes celulares, como lo sugieren las pruebas in vitro, ex vivo e in vivo [5-14], y este potencial se puede utilizar para regenerar los tejidos dañados. Además, las células madre mesenquimales secretan una gran variedad de moléculas bioactivas que actúan de forma paracrina para alimentar, estimular y sostener respuestas angiogénicas (formación de vasos sanguíneos), antifibróticas, antiapoptóticas (frenando la muerte celular) e inmunomoduladoras en el tejido diana sobre el que se utilizan[2, 15].

Las MSCs derivadas de tejido adiposo se obtienen de manera habitual mediante digestión enzimática y pueden expandirse en cultivo, pero envejecen de forma significativa y disminuye su multipotencialidad. El uso de estos enzimas para la digestión de la grasa orientada a obtener esas MSCs ha supuesto la aparición de restricciones en algunos países.
La necesidad urgente de encontrar nuevas terapias para las enfermedades crónicas inmunológicas y degenerativas ha llevado a muchos investigadores a buscar productos que contengan células progenitoras, evitando al mismo tiempo los problemas y restricciones relacionados con la manipulación enzimática y la expansión celular de conformidad con las buenas prácticas de fabricación (normas GMP) [16, 17].
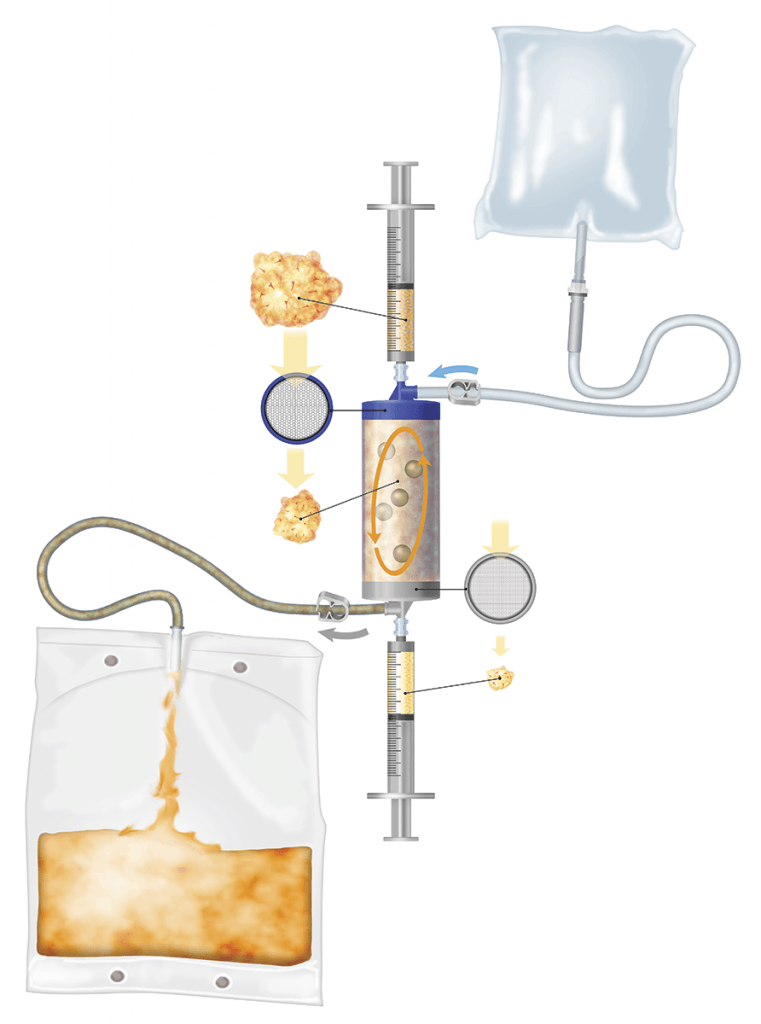
La disponibilidad de productos mínimamente manipulados basados en un contenido adecuado de células madre ha dado como resultado tiempos de procedimiento más cortos y la capacidad de aplicar injertos autólogos en una intervención de un solo paso. La tecnología Lipogems® garantiza estos dos requisitos en un dispositivo de transferencia de tejido adiposo fácil de usar, rápido y desechable y representa un enfoque muy prometedor.
La técnica innovadora Lipogems® (Lipogems International SpA, Milán, Italia) permite obtener tejido adiposo microfragmentado con un nicho vascular estromal intacto y células madre mesenquimales con una alta capacidad regenerativa. La tecnología Lipogems®, patentada en 2010 y disponible clínicamente desde 2013, es un sistema fácil de usar diseñado para recolectar, procesar e inyectar tejido graso refinado y se caracteriza por su capacidad óptima de manejo y un gran potencial regenerativo basado en células madre derivadas de la grasa. En esta tecnología, el tejido adiposo se lava, se emulsiona y se enjuaga y las dimensiones del grano adiposo se reducen gradualmente hasta un rango de aproximadamente 0,3 a 0,8 mm.
En el producto Lipogems® resultante, los pericitos que envuelven a los vasos sanguíneos se retienen dentro de un nicho vascular estromal intacto y están listos para interactuar con el tejido receptor después del trasplante, activándose y convirtiéndose así en MSCs (células madre mesenquimales) y comenzando el proceso regenerativo.
Lipogems® se ha utilizado en más de 10.000 pacientes en todo el mundo en medicina estética y cirugía, así como en cirugía ortopédica y cirugía general, con buenos resultados y aparentemente sin inconvenientes. A día de hoy, ya existen varios ensayos clínicos con resultados satisfactorios.
FUENTE:
Adipose Tissue and Mesenchymal Stem Cells: State of the Art and Lipogems® Technology Development. Curr Stem Cell Rep. 2016; 2(3): 304–312.
Published online 2016 Jul 13. doi: 10.1007/s40778-016-0053-5
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4972861/
Referencias
- 1. Wilson EB. The cell in development and inheritance. New York: Macmillan; 1898.
- 2. Caplan AI. Adult mesenchymal stem cells for tissue engineering versus regenerative medicine. J Cell Physiol. 2007;213(2):341–7. doi: 10.1002/jcp.21200. [PubMed] [Cross Ref]
- 3. Ventura C, Cantoni S, Bianchi F, Lionetti V, Cavallini C, Scarlata I, et al. Hyaluronan mixed esters of butyric and retinoic acid drive cardiac and endotelial fate in term placenta human mesenchymal stem cells and enhance cardiac repair in infarcite rat hearts. J Biol Chem. 2007;282(19):14243–52. doi: 10.1074/jbc.M609350200. [PubMed] [Cross Ref]
- 4. Cavallari G, Olivi E, Bianchi F, Neri F, Foroni L, Valente S, et al. Mesenchymal stem cells and islet cotransplantation in diabetic rats: improve islet graft revascularization and function by human adipose tissue-derived stem cells preconditioned with natural molecule. Cell Transplant. 2012;21(12):2771–81. doi: 10.3727/096368912X637046. [PubMed] [Cross Ref]
- 5. Canaider S, Maioli M, Facchin F, et al. Human Stem Cell exposure to developmental stage zebrafish extracts: a novel strategy for turning stemness and senescence patterning. CellR4. 2014;2(5):1226.
- 6. Cao Y, Sun Z, Liao L, Meng Y, Han Q, Zhao RC. Human adipose tissue-derived stem cells differentiate into endothelial cells in vitro and improve postnatal neovascularization in vivo. Biochem Biophys Res Commun. 2005;332(2):370–9. doi: 10.1016/j.bbrc.2005.04.135. [PubMed] [Cross Ref]
- 7. Fraser JK, Schreiber R, Strem B, Zhu M, Alonso Z, Wulur I, et al. Plasticity of human adipose stem cells towards endothelial cells and cardiomyocytes. Nat Clin Pract Cardiovasc Med. 2006;3(Suppl1):S33–7.
- 8. Sen A, Lea-Currie YR, Suijkowska D, Franklin DM, Wilkison WO, Halvorsen YD, et al. Adipogenic potential of human adipose derived stromal cells from multiple donors is heterogeneous. J Cell Biochem. 2001;205(1):312–9. doi: 10.1002/1097-4644(20010501)81:2<312::AID-JCB1046>3.0.CO;2-Q. [PubMed][Cross Ref]
- 9. Zuk PA, Zhu M, Ashjian P, De Ugarte DA, Huang JI, Mizuno H, et al. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell. 2002;13(12):4279–95. doi: 10.1091/mbc.E02-02-0105.[PMC free article] [PubMed] [Cross Ref]
- 10. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001;7(2):211–28. doi: 10.1089/107632701300062859. [PubMed] [Cross Ref]
- 11. Erickson GR, Gimble JM, Franklin DM, Rice HE, Awad H, Guilak F. Chondrogenic potential of adipose tissue-derived stromal cells in vitro and in vivo. Biochem Biophys Res Commun. 2002;290(2):763–9. doi: 10.1006/bbrc.2001.6270. [PubMed] [Cross Ref]
- 12. Halvorsen YC, Wilkison WO, Gimble JM. Adipose-derived stromal cells—their utility and potential in bone formation. Int J Obes Relat Metab Disord. 2000;24(4):S41–4. doi: 10.1038/sj.ijo.0801503. [PubMed][Cross Ref]
- 13. Halvorsen YD, Franklin D, Bond AL, Hitt DC, Auchter C, Boskey AL, et al. Extracellular matrix mineralization and osteoblast gene expression by human adipose tissue-derived stromal cells. Tissue Eng. 2001;7(6):729–41. doi: 10.1089/107632701753337681. [PubMed] [Cross Ref]
- 14. Huang JI, Beanes SR, Zhu M, Lorenz HP, Hedrick MH, Benhaim P. Rat extramedullary adipose tissue as a source of osteochondrogenic progenitor cells. Plast Reconstr Surg. 2002;109(3):1033–41. doi: 10.1097/00006534-200203000-00037. [PubMed] [Cross Ref]
- 15.•. Caplan AI, Dennis JE. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 2006;98(5):1076–84. doi: 10.1002/jcb.20886. [PubMed] [Cross Ref]
- 16. Roseti L, Serra M, Tigani D, Brognara I, Lorpiore A, Bassi A, et al. Cell manipulation in autologous chondrocyte implantation: from research to clean room. Chir Organi Mov. 2008;91(3):147–51. doi: 10.1007/s12306-007-0024-1. [PubMed] [Cross Ref]
- 17. Riis S, Zachar V, Boucher S, Vemuri MC, Pennisi CP, Fink T. Critical steps in the isolation and expansion of adipose-derived stem cells for translational therapy. Expert Rev Mol Med. 2015;17:e11.
- 18. Caplan A. Mesenchymal Stem Cells. J Orthopedic Res. 1991;9(5):641–50. doi: 10.1002/jor.1100090504.[Cross Ref]
- 19. Caplan A, Bruder SP. Mesenchymal stem cells: building blocks for molecular medicine in the 21st century. Trends Mol Med. 2001;7(6):259–64. doi: 10.1016/S1471-4914(01)02016-0. [PubMed] [Cross Ref]
- 20. Caplan A. All MSCs are pericytes? Cell Stem Cell. 2008;3(3):229–30. doi: 10.1016/j.stem.2008.08.008.[PubMed] [Cross Ref]